- ·云南铝及铝合金AW-6005A-T6...
- ·包邮日本USHIO紫外线灯管 UXL...
- ·原装日本USHIO紫外线灯管 UXL...
- ·贵州铝及铝合金AW-6005A-T6...
- ·日本USHIO紫外线灯管 UXL-3...
- ·USHIO 紫外线灯管 UXL-30...
- ·四川铝及铝合金AW-6005A-T6...
- ·便携式手持多参数水质速测仪售后服务
- ·海南铝及铝合金AW-6005A-T6...
- ·原厂直销DI-SORIC感应传感器D...
- · CJX620
- ·广西铝及铝合金AW-6005A-T6...
- · 电子天平 CJX620
- ·多参数水质测试仪配置清单
- ·现货日本VIBRA 电子天平 CJX...
高通量单分子定位显微成像技术进展
由于衍射极限的存在,传统的光学成像手段无法观测细胞器结构及细胞器之间的相互作用。单分子定位显微成像技术作为三种分辨技术中分辨率*的成像技术,为生命科学领域的研究提供了重要手段。
大视场高通量单分子成像技术具有分辨率高、成像范围大和成像时间短等特点,在生物医学领域广泛用于观察和分析复杂的生物结构和功能。

南方科技大学生物医学工程系的林昭珺团队发表文章,从基于硬件扫描的拼接成像技术、基于大面阵sCMOS的大视场高通量成像技术、大景深单分子定位成像技术、高通量数据分析技术4个方面回顾近年来大视场高通量单分子定位技术的研究进展。*,对大视场高通量单分子定位成像技术的发展方向进行展望。
研究背景
一、传统成像技术的局限与分辨显微成像技术的兴起
传统光学成像受衍射极限限制,横向分辨率约250nm,轴向分辨率约500nm,难以观测细胞器结构及相互作用。电子显微镜虽分辨率高,但存在制样复杂、缺乏分子特异性和无法多色成像等问题,无法用于活细胞成像。
分辨显微成像技术应运而生,主要包括结构光照明显微成像技术(SIM)、受激发射损耗显微成像技术(STED)和单分子定位成像技术(SMLM),其中SMLM分辨率*,横向可达 20-30nm,轴向可达60nm。
二、单分子定位技术原理及应用
单分子定位技术通过让视场范围内荧光分子随机稀疏激活发光,利用定位算法拟合单分子点空间位置,多次循环采集完成定位,实现分辨成像。
该技术广泛应用于观测细胞骨架、膜蛋白分布和细胞器相互作用等,但传统方法需采集大量原始数据,成像时间长、数据存储和分析压力大。
三、高通量成像的重要性及需求
高通量成像在观察细胞形态、筛选和分析大量细胞表型等方面优势显著,可在单次采集中获取更多成像数据。
随着单分子定位技术应用增多,对其视场大小和吞吐量要求提高,高通量分辨成像有助于探究不同细胞种群差异,对跨尺度成像意义重大。
基于硬件扫描的拼接成像
一、技术实现方式及案例
Holden等改进硬件和软件构建高通量PALM,将10/90分束镜用于定制显微镜,90%光用于3D-PALM,采用自动闭环控制荧光团密度机制,利用805nm激光反射光自动锁焦,对数百个活新月杆菌FtzS进行三维成像并定量分析Z-ring纳米级结构。

高稳定显微镜
Mund等设计的显微镜在样品上划分区域,预定义激光强度等参数自动采集,平台移动后有机械平衡时间,引入近红外激光和象限光电二极管实现z方向锁焦,研究内吞过程中内吞蛋白组织结构。
Beghin等提出的全自动化显微镜平台集成多种模块,低倍镜筛选后高倍镜分辨成像,自动锁焦减少漂移,对96孔样品板微管成像,三维定位和图像重建耗时8h,平均每孔5min。
二、自动聚焦技术的应用与发展
单分子定位技术长时间成像易受温度等因素导致图像漂移,自动聚焦技术至关重要。传统自动聚焦技术分两类,近期深度学也用于此,如Pinkard等根据散斑信号利用卷积神经网络量化离焦量,Lightley等引入额外激光和相机,通过深度学分析反射光斑图像实现自动聚焦,训练好的模型应用于显微成像系统可快速自动对焦。
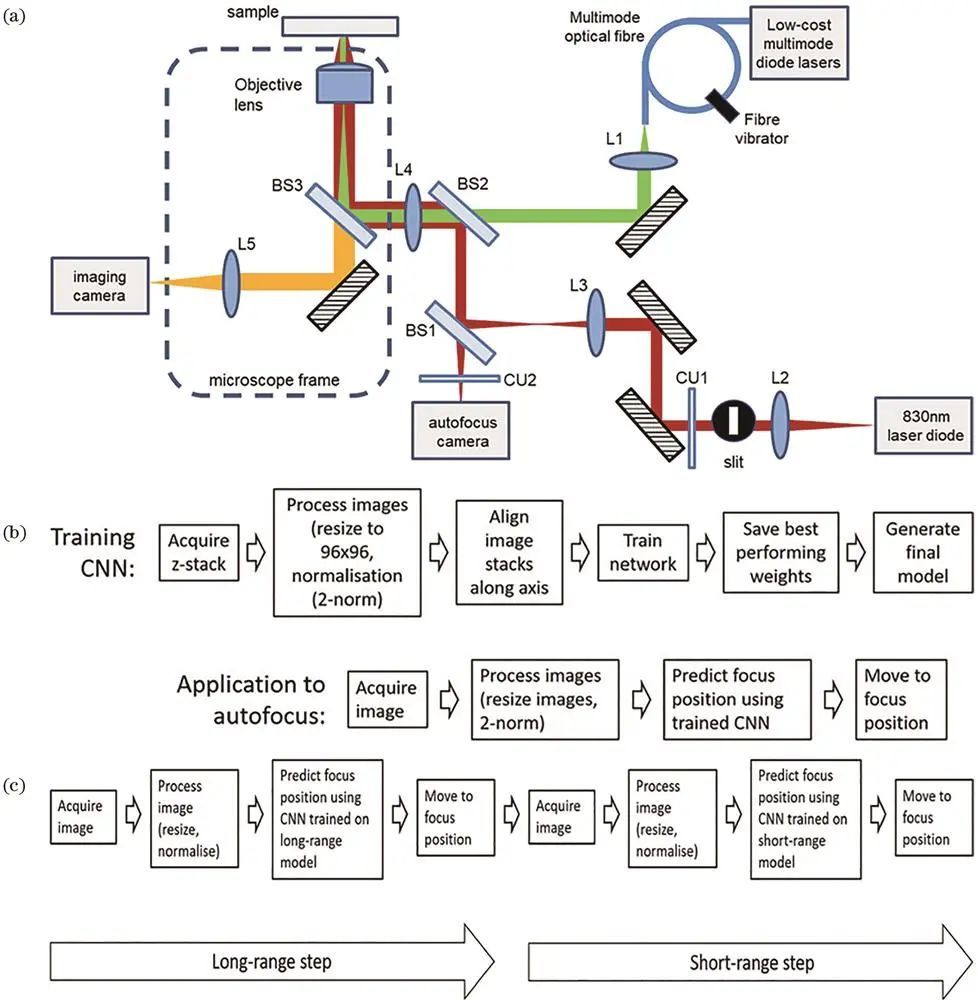
自动对焦的easySTORM
三、存在的问题
基于硬件扫描的拼接成像受位移台精度和拼接算法影响大,对位移台和图像配准精度要求严苛,否则会产生伪影影响成像质量。
相邻子区域多次受激光照射,增加光毒性且荧光易漂白;图像拼接时相邻图像可能不连续;需定制硬件设施和额外锁焦系统,操作复杂、成本高;成像时间久。
基于大面阵相机的非拼接式成像
一、技术优势与面临的挑战
传统单分子定位显微系统中,传感器面积和传感单元数量限制了分辨能力和视场大小,二者相互制约。大面阵sCMOS传感器的出现使兼顾两者成为可能,但面临大视场均匀照明和像差校正等挑战。
二、实现均匀照明的多种方法
1、光束整形
Douglass等利用微透镜阵列将高斯光束整形为平顶光束,扩大照明面积约4倍,受机械振动影响小、成本低,但场适应性有限;还有基于pi-shaper、top-shape等元件的光束整形方法。
2、多模光纤
Zhao等利用激光光束组合器和多模光纤实现大视场均匀照明,保证照明功率密度;Deschamps等将多模激发与TIRF技术结合,获得均匀荧光亮度和光学切片效果。
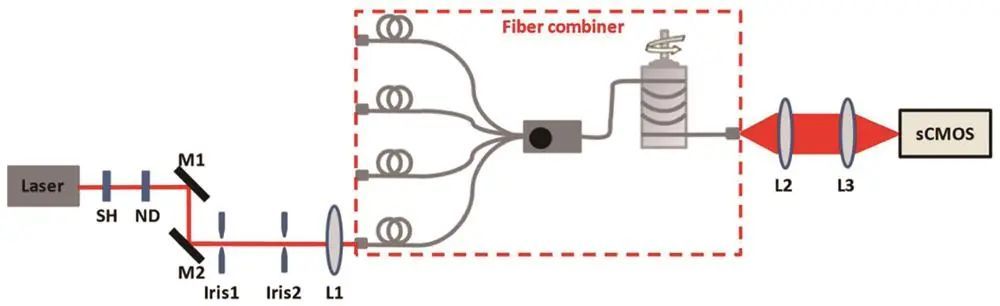
基于多模光纤的大视场均匀照明方案的光路
3、波导技术
Diekmann等提出的Waveguide-TIRF技术利用波导产生均匀TIRF照明,降低背景噪声、提高信噪比和分辨率,但存在照明区域难限制、会同时照明和漂白整个样品、波导制备与系统复杂等问题。
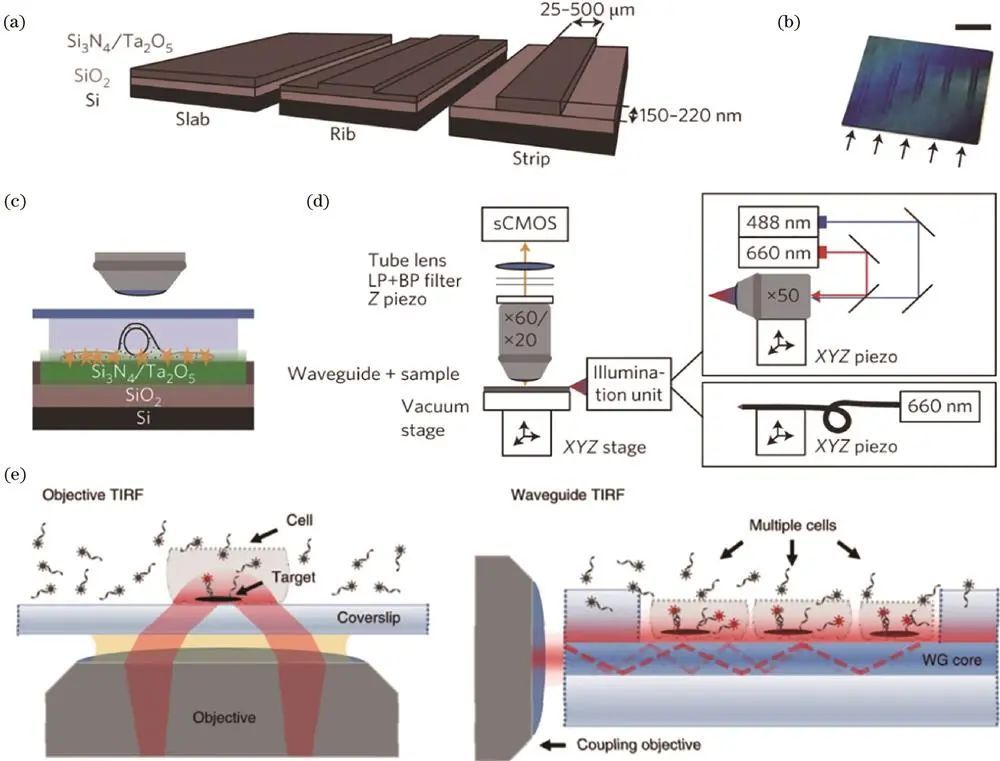
Waveguide-TIRF技术原理
4、扫描振镜
Mau等利用振镜扫描高斯光束实现约200μm×200μm视场均匀照明,需保证扫描与曝光高度同步,增加系统复杂度。
5、棱镜式照明
Foylan等提出的MesoTIRF照明方案利用棱镜和发物镜实现大视场TIRF照明;Rames等利用4π笼式透镜实现TIRF与Hilo两种照明模式切换,提供较高轴向分辨率。
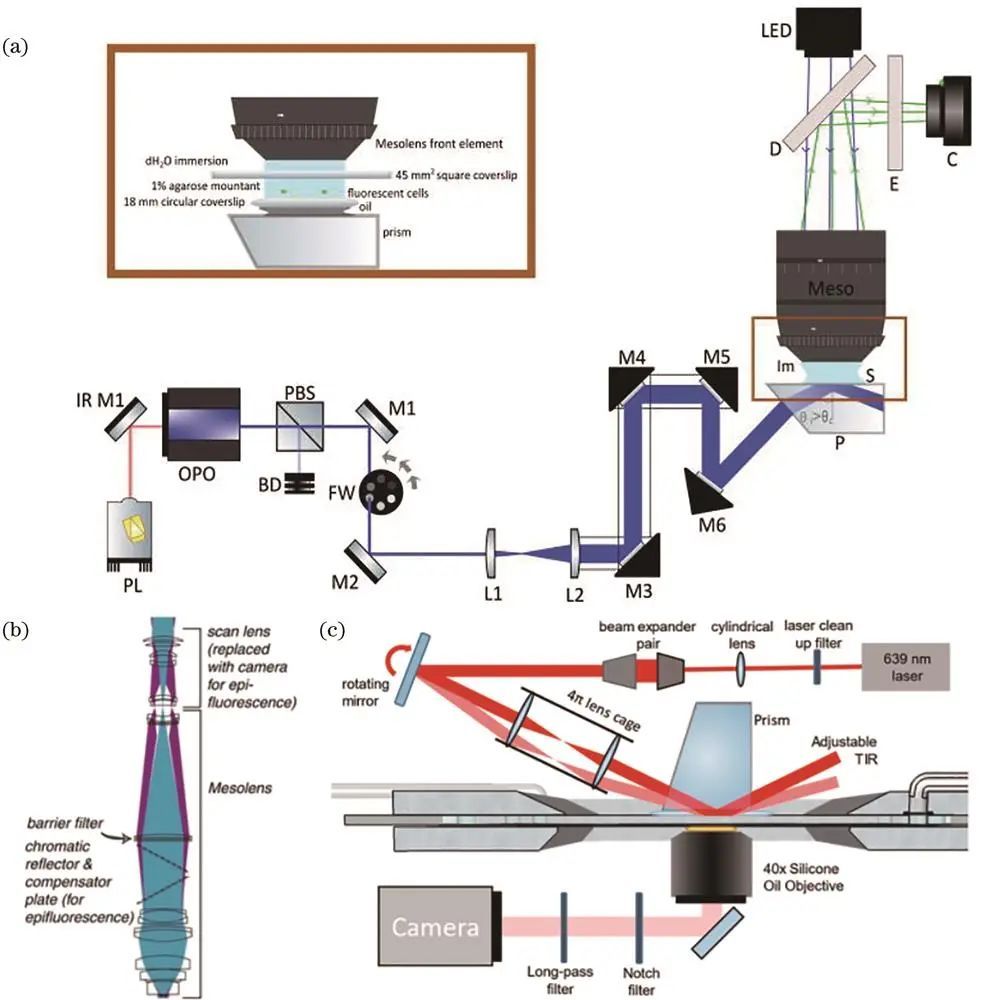
两种基于棱镜的大视场照明方案
大景深单分子定位技术
一、技术难点及解决思路
传统高斯点扩散函数在焦平面前后光场分布对称,景深和轴向光场变化幅度小,无法判断单分子点位置,一次成像只能拍摄焦面附近单分子点。为克服此问题,研究者提出点扩散函数工程、远聚焦等技术路线。
二、点扩散函数工程的具体方法及应用
1、散光点扩散函数
庄小威课题组首次将散光像差引入STORM系统,通过插入柱面镜调制,实现±600nm范围内三维定位,轴向分辨率约50nm,因便捷性广泛应用。
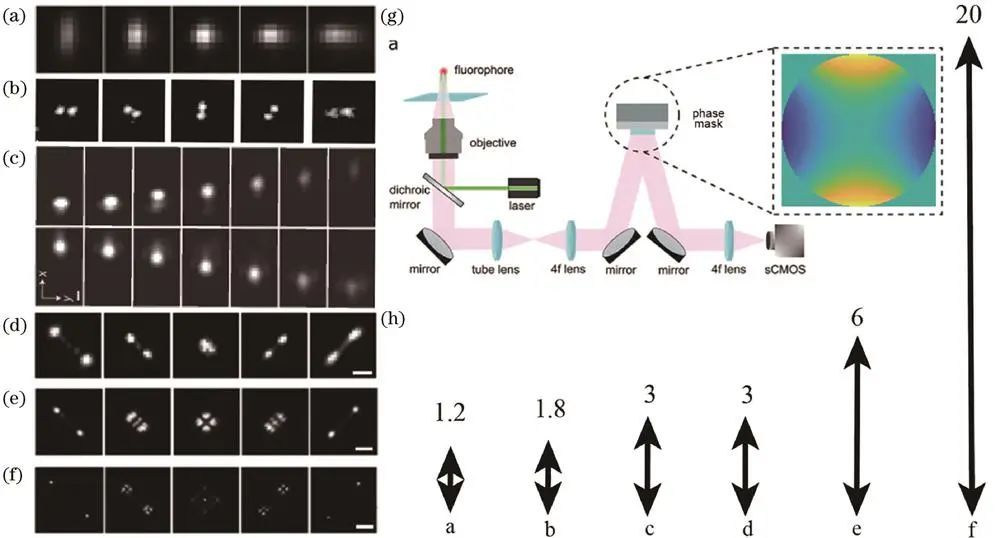
不同点扩散函数示意图与景深对比
2、双螺旋点扩散函数
Moerner课题组利用相位板实现,其形状随焦深变化,景深约±900nm,定位精度对轴向位置敏感度低,实现10-20nm轴向分辨率和约2μm景深三维成像。
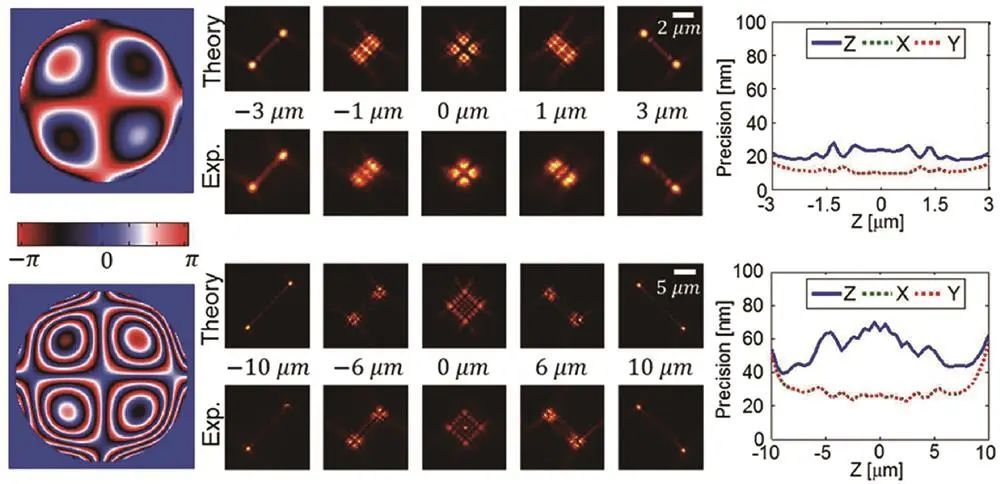
6μ μm-Tetrapod与20μ μm-Tetrapod及其相位示意图
3、自弯曲点扩散函数
庄小威课题组利用艾里光束设计,通过其不同焦深横向位置定位荧光分子,实现3μm成像范围内10-15nm三维定位,但使用空间光调制器会降低信噪比。
4、Tetrapod点扩散函数
Moerner课题组基于相位板调制出一系列,拥有*景深可达20μm,定位精度较高,在多色成像、活细胞成像等方面有应用,如对活芽酵母细胞染色质动力学进行三维追踪成像;2022年Fu等利用可变形镜优化,提升定位精度。
三、远聚焦技术的原理及实例
远聚焦成像系统中,前两个物镜将焦平面附近光场“投影”在第三个物镜焦点处,通过移动第三个物镜改变焦平面位置实现大景深成像。如Booth课题组利用可变形镜实现多平面成像,Radenovic课题组将其与像差校正点扩散函数工程结合优化后对COS-7细胞成像,Mondal课题组利用电动可调焦透镜特性实现约4.5μm轴向范围成像。
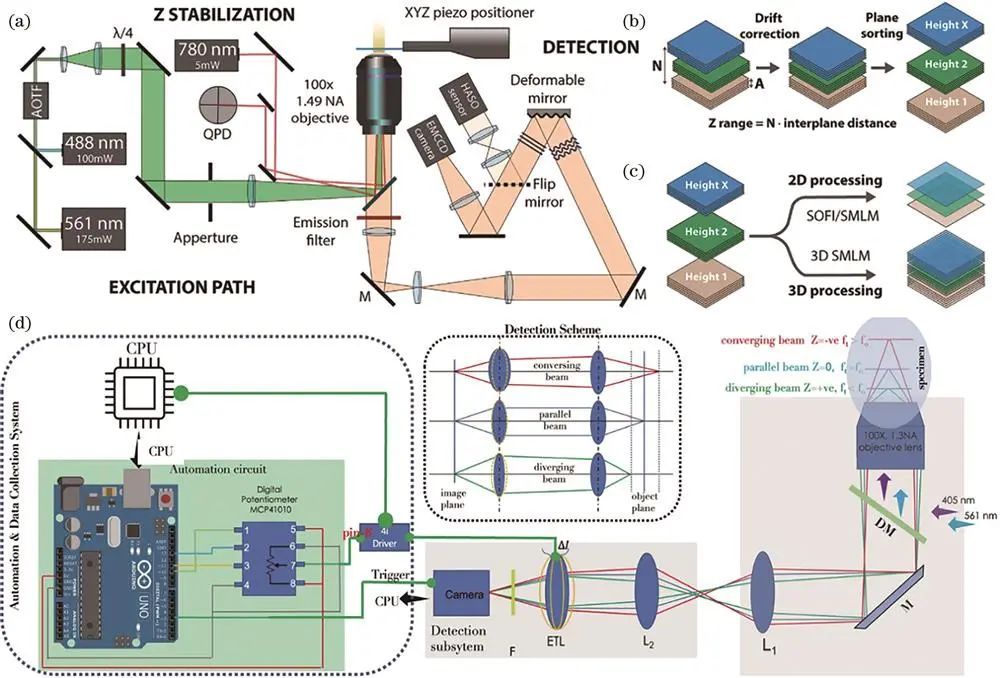
基于可变形镜或ETL的远聚焦技术原理
高通量数据分析
一、数据处理压力与加速策略
sCMOS数据采集通量高,但带来海量数据处理压力。常用高性能GPU加速计算集群等方法,如Hu等利用Amazon EC2加速3B分析,Li等提出QC-STORM方法提高处理速度,Gui等提出HCP-STORM异构计算平台,速度大幅提升。
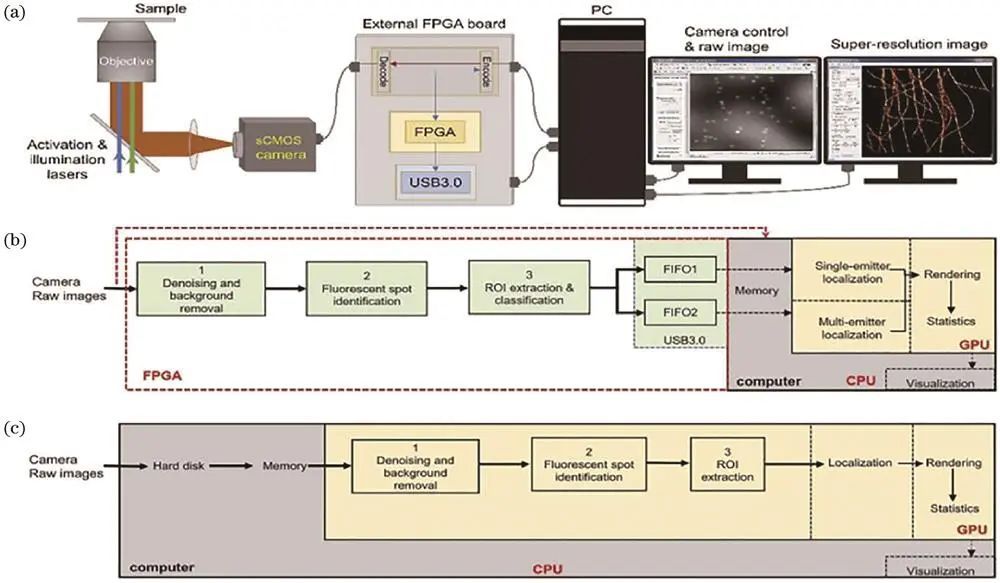
分辨定位显微镜处理原始图像的异构平台
二、图像拼接的创新方法及优势
传统拼接方法基于灰度图,Du等提出用定位表代替灰度图的NanoStitcher方法,经确定重叠区域、预处理、拼接、优化路径、融合平滑等步骤,处理后的微管图像结构清晰连续,在*小化文件大小和存储无损文件方面有优势。
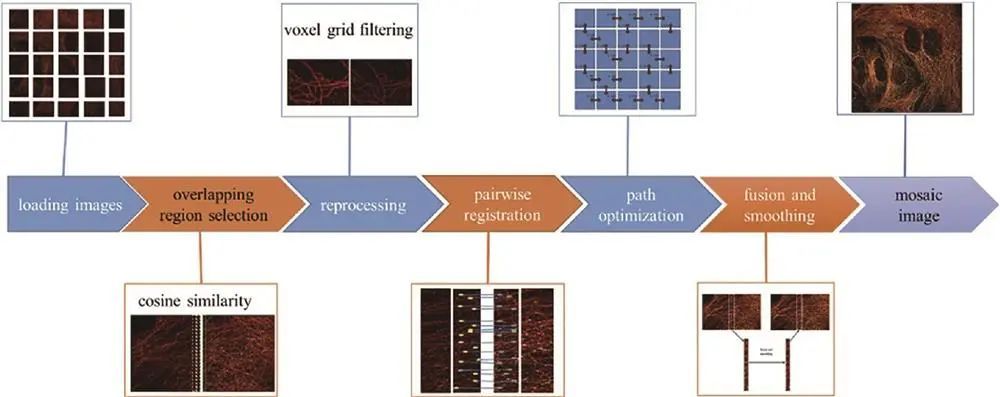
全景分辨图像计算框架
三、其他相关方法及成果
Barentine等提出采集和分析一体化的高通量纳米显微镜,配有自动锁焦等机制,开发压缩算法和优化代码,实现实时定位,成像数万个细胞只需*。本课题组提出FD-DeepLoc方法,基于深度学校正大视场像差,实现大视场全细胞分辨成像,提升三维SMLM成像通量约100倍。
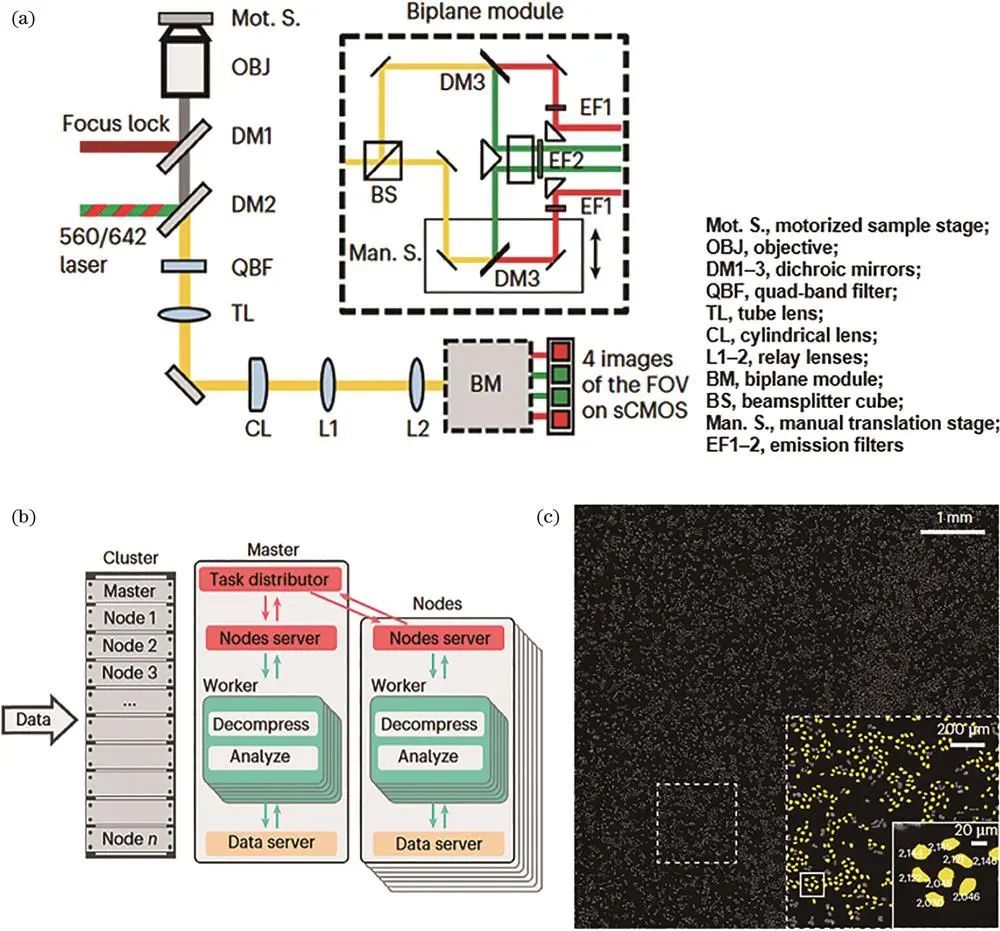
高通量单分子定位显微镜
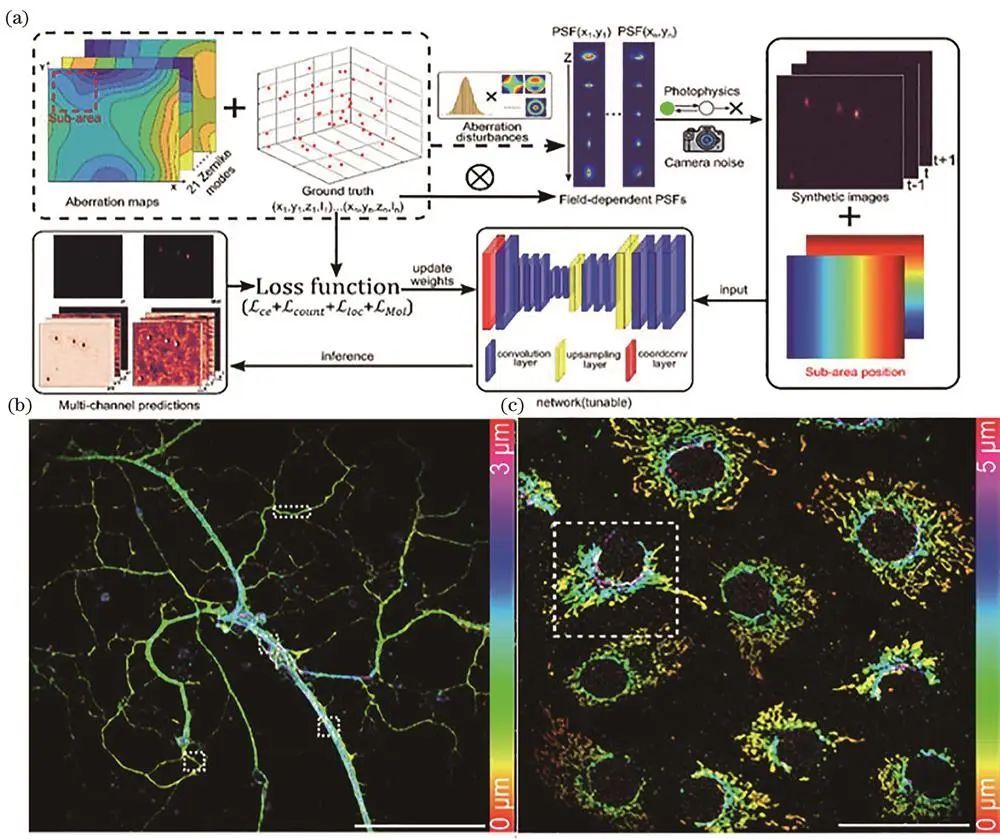
FD-DeepLoc示意图
结与展望
在工程应用方面,目前常将多种高通量单分子成像方法相结合,例如大面阵sCMOS成像技术与点扩散函数工程以及高通量数据分析技术相互配合,以此获得更*的成像效果。
展望未来,为进一步提高单分子定位成像通量,可从多个方向进行优化。在激发照明上,可把高功率激光与激发光扫描技术相结合,并采用快速闪烁染料;成像光路方面,调制系统点扩散函数以获取适合大视场低采样率的点扩散函数来提升定位精度;数据处理时,利用深度学矫正更大视场范围的场相关像差;系统设计层面,通过高密度成像配合基于深度学的数据分析减少成像所需帧数,从而提高成像速度及通量。
之,该技术在成像系统多方面的优化中极具研究价值与应用潜力。
声明:本文仅用作学术目的。文章来源于:林昭珺, 常桓梽, 李依明. 高通量单分子定位显微成像技术进展(特邀)[J]. 激光与光电子学进展, 2024, 61(6): 0618004. Zhaojun Lin, Huanzhi Chang, Yiming Li. Advances in High-Throughput Single-Molecule Localization Microscopy (Invited)[J]. Laser & Optoelectronics Progress, 2024, 61(6): 0618004.

